2023年9月�,真邁生物合作客戶復(fù)旦大學(xué)附屬中山醫(yī)院孫愛(ài)軍和葛均波團(tuán)隊(duì)在《Redox Biology》(IF: 11.4) 雜志上發(fā)表了一篇題為“缺血再灌注模型中內(nèi)源性腺苷的積累通過(guò)表觀遺傳重編程改善心肌細(xì)胞代謝”的科研文章。該文章探討了心臟細(xì)胞中腺苷激酶(ADK)在心肌缺血再灌注(I/R)損傷中的作用���,并探索了其作為治療靶點(diǎn)的潛力��。研究發(fā)現(xiàn),通過(guò)抑制ADK���,可以導(dǎo)致心肌細(xì)胞內(nèi)腺苷積累�,降低DNA甲基轉(zhuǎn)移酶1(DNMT1)的表達(dá)�,并引起基因組的低甲基化。此外����,ADK敲除還增加了胰島素樣生長(zhǎng)因子-1(IGF-1)的轉(zhuǎn)錄,促進(jìn)心肌細(xì)胞的葡萄糖代謝�����。這些變化共同作用可以減輕心肌缺血再灌注損傷�,該研究提供了一種新的治療策略。
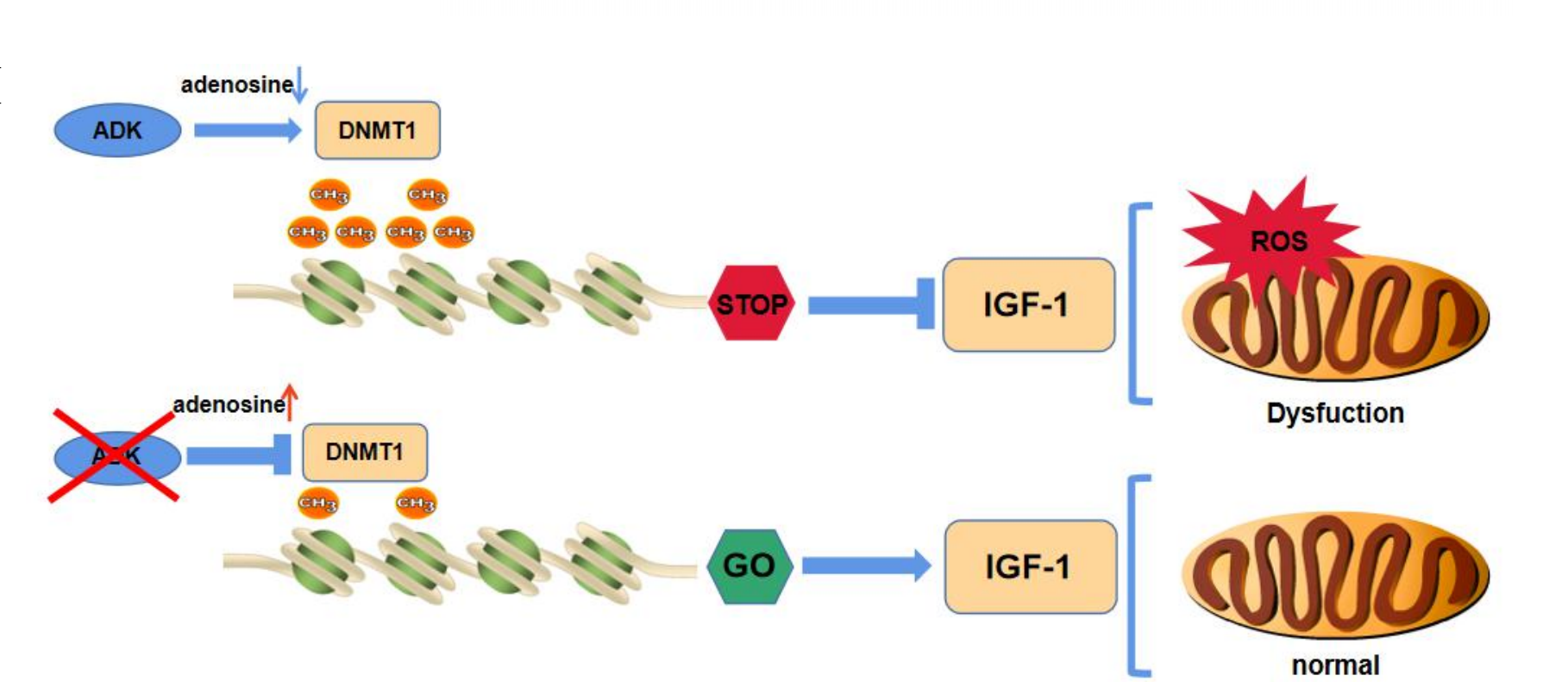
心臟缺血再灌注(I/R)損傷會(huì)引起缺血性心臟病的長(zhǎng)期不良預(yù)后��,且與缺血性心臟病的高發(fā)病率相關(guān)。因此��,尋找減輕再灌注損傷的新靶點(diǎn)是臨床治療中亟需解決的問(wèn)題�。腺苷激酶(ADK)在心臟腺苷代謝中起著重要作用,而抑制ADK會(huì)增加心肌腺苷水平��。盡管已有研究證實(shí)細(xì)胞外腺苷對(duì)缺血/再灌注(I/R)的心臟有保護(hù)作用���,但是ADK在心臟I/R損傷中的作用機(jī)制目前尚不清楚�。
研究者構(gòu)建了不同時(shí)間點(diǎn)的I/R小鼠模型�����,使用真邁生物GenoLab?M測(cè)序儀對(duì)I/R組和對(duì)照組樣本進(jìn)行了轉(zhuǎn)錄組測(cè)序��。結(jié)果表明:相對(duì)對(duì)照組�����,ADK基因的表達(dá)在I/R組顯著上調(diào)����。通過(guò)與ADK相關(guān)通路分析發(fā)現(xiàn)�,在I/R組中,ADK���、DNMT1(DNA甲基化轉(zhuǎn)移酶1的編碼基因����,負(fù)責(zé)在細(xì)胞分裂過(guò)程中維持DNA甲基化水平)和其他代謝相關(guān)基因發(fā)生了顯著變化(圖2C)。此外��,相關(guān)性分析顯示����,ADK與IGF-1(胰島素樣生長(zhǎng)因子1的編碼基因,對(duì)細(xì)胞生長(zhǎng)����、增殖和存活起重要作用)呈強(qiáng)負(fù)相關(guān),與DNA甲基化相關(guān)編碼基因呈中等負(fù)相關(guān)(圖2D)���。
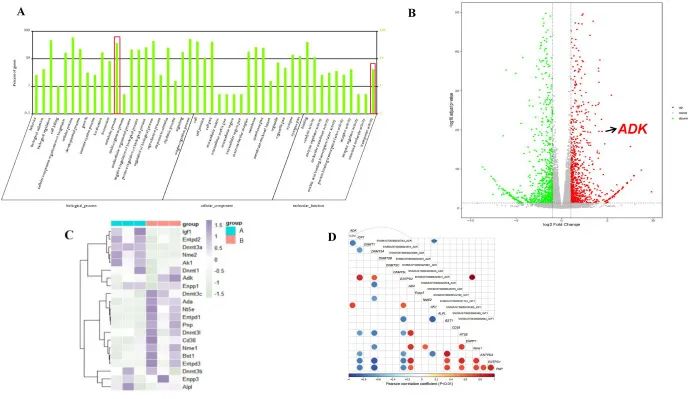
圖2?ADK被發(fā)現(xiàn)是參與I/R期間代謝變化的潛在候選基因
此外研究發(fā)現(xiàn)���,敲除心肌細(xì)胞中ADK基因可以導(dǎo)致細(xì)胞內(nèi)腺苷積累,降低DNA甲基轉(zhuǎn)移酶1(DNMT1)的表達(dá)�����,并導(dǎo)致DNA低甲基化狀態(tài)。這些變化與改善心肌細(xì)胞的葡萄糖代謝和減輕心肌I/R損傷有關(guān)�����。ADK的缺失通過(guò)調(diào)節(jié)DNMT1和胰島素樣生長(zhǎng)因子-1(IGF-1)的表達(dá)�,發(fā)揮心臟保護(hù)作用。IGF-1的表達(dá)增加可以逆轉(zhuǎn)ADK缺失對(duì)心肌I/R損傷的保護(hù)效應(yīng)�����,表明增加IGF-1表達(dá)可能具有治療心肌I/R損傷的潛力��。最后通過(guò)動(dòng)物模型和細(xì)胞實(shí)驗(yàn)����,研究人員進(jìn)一步探索了ADK缺失對(duì)心肌能量代謝的影響,并發(fā)現(xiàn)ADK/DNMT1/IGF-1軸在調(diào)節(jié)心肌細(xì)胞能量代謝中起著重要作用����。
總的來(lái)說(shuō),該研究揭示了心肌細(xì)胞中ADK的缺失對(duì)心肌I/R損傷的保護(hù)作用���,以及ADK/DNMT1/IGF-1軸在調(diào)節(jié)心肌能量代謝和心臟保護(hù)中的重要性����。
本研究通過(guò)轉(zhuǎn)錄組測(cè)序發(fā)現(xiàn)ADK基因在I/R組中高表達(dá),隨后探究了ADK在心肌I/R損傷中的作用及其對(duì)葡萄糖代謝的影響���。研究表明,ADK缺失誘導(dǎo)的腺苷積累和隨后DNMT1和IGF-1表達(dá)的調(diào)節(jié)有助于觀察到的心臟保護(hù)作用�����。這些發(fā)現(xiàn)有助于我們理解心臟健康和患病狀態(tài)下代謝與表觀遺傳修飾之間復(fù)雜的相互作用�����。
Wang P, Gao R, Wu T, et al. Accumulation of endogenous adenosine improves cardiomyocyte metabolism via epigenetic reprogramming in an ischemia-reperfusion model[J]. Redox Biology, 2023, 67: 102884.